Автор:
Lewis Jackson
Дата На Създаване:
8 Може 2021
Дата На Актуализиране:
25 Юни 2024

Съдържание
Нетното йонно уравнение е важна част от химията, тъй като представлява само частиците, които се променят при химична реакция. Най-често се използват в окислително-редукционни реакции, метаболитни реакции и неутрализационни реакции на киселини - основи. Има три основни стъпки за писане на нетно йонно уравнение: балансирайте молекулното уравнение, преобразувайте го в пълното йонно уравнение (как всяко вещество съществува в разтвор) и накрая напишете нетно йонно уравнение.
Стъпки
Част 1 от 2: Разбиране на компонентите на йонното уравнение
Знаете разликата между молекулите и йонни съединения. Първата стъпка при написването на нетно йонно уравнение е да се определят йонните съединения в реакцията. Йонните съединения са тези, които дисоциират йони във воден разтвор и имат електрически заряд. Молекулните съединения са съединения, които никога нямат електрически заряд. Те се образуват между два неметала и понякога се наричат ковалентни съединения.
- Йонни съединения могат да се образуват между метали и неметали, метали и многоатомни йони или множество полиатомни йони.
- Ако не сте сигурни какво е съединението, можете да потърсите елементите в него в периодичната таблица.

Разпознава разтворимостта на съединение. Не всички йонни съединения са разтворими във воден разтвор и следователно не могат да се дисоциират в йони. Трябва да идентифицирате разтворимостта на всяко съединение, преди да продължите с останалото уравнение. По-долу е дадено обобщение на правилата за разтворимост. Намерете електронна таблица за разтворимост за по-подробна информация и изключения от тези правила.- Следвайте тези правила в реда, посочен по-долу:
- Всички Na, K и NH соли4 всички се топят.
- Всички НЕ соли3, ° С2З.3О2, ClO3и ClO4 всички се топят.
- Всички соли на Ag, Pb и Hg2 всички се разтварят.
- Всички соли на Cl, Br и I са разтворими.
- Всички CO соли3, O, S, OH, PO4, CrO4, Cr2О7, и така3 се разтварят (с изключение на няколко случая).
- Всички SO соли4 се разтварят (с изключение на няколко случая).
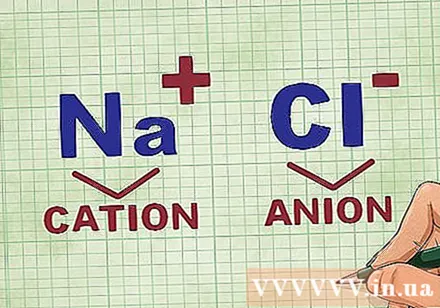
Определяне на катиони и аниони в съединение. Катионите са положителните йони в съединението и обикновено са металът. Анионът е отрицателният йон в съединението и е неметален. Някои неметали могат да образуват катиони, но металите винаги образуват катиони.- Например в NaCl Na е положително зареденият катион, защото е метал, а Cl е отрицателно зареденият анион, защото е неметален.

Разпознават многоатомните йони в реакцията. Многоатомните йони са заредени молекули, които са здраво свързани помежду си и не се дисоциират по време на химични реакции. Важно е да се разпознаят многоатомните йони, защото те имат специфичен заряд и не дисоциират. Многоатомните йони могат да имат положителен или отрицателен заряд.- Ако изучавате обща химия, често се изисква да запомните някои често срещани многоатомни йони.
- Някои често срещани многоатомни йони са CO3, НЕ3, НЕ2, ТАКА4, ТАКА3, ClO4 и ClO3.
- Можете също така да намерите много други йони в книгите по химия или в интернет.
Част 2 от 2: Написване на нетно йонно уравнение
Балансирайте молекулярните уравнения. Преди да напишете нетно йонно уравнение, трябва да се уверите, че вашето молекулно уравнение е балансирано. За да балансирате уравнението, добавяте коефициенти пред съединението, така че атомният номер на всеки елемент да е равен от двете страни на уравнението.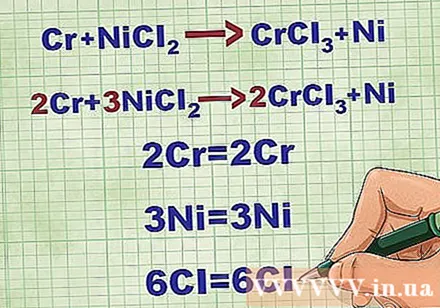
- Напишете броя на атомите, които съставляват всяко съединение от двете страни на уравнението.
- Добавете коефициент пред елементи, различни от кислород и водород, за да балансирате всяка страна.
- Баланс на водородните атоми.
- Кислороден атомен баланс.
- Отчетете броя на атомите от всяка страна на уравнението, за да сте сигурни, че са балансирани.
- Например Cr + NiCl2 -> CrCl3 + Ni Балансиран до 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Идентифицирайте състоянието на съединението в уравнението. Много пъти в проблема има ключови думи, които да ви информират за състоянието на всяко съединение. Има няколко правила, които помагат да се определи състоянието на даден елемент или съединение.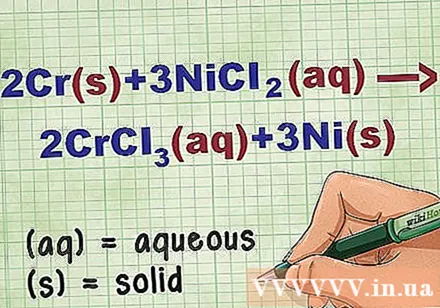
- Ако състоянието на даден елемент не е предоставено, използвайте състоянието, намерено в периодичната таблица.
- Ако съединението се нарича решение, можете да го напишете като воден или ((дд).
- Ако в уравнението има вода, трябва да определите дали йонното съединение е водоразтворимо, като използвате електронната таблица за разтворимост. Ако разтворимостта е висока, съединението ще бъде водно (дд), ако разтворимостта е ниска, съединението ще бъде твърдо (r).
- Без вода йонното съединение е твърдо (r).
- Ако проблемът е киселинен или основен, тогава съединението е водно (дд).
- Например 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Елементарните форми на Cr и Ni са в твърдо състояние. NiCl2 и CrCl3 йонните съединения са разтворими, така че са водни. Напишете уравнението като: 2Cr(r) + 3NiCl2(дд) -> 2CrCl3(дд) + 3Ni(r).
Определете кои съединения ще се дисоциират (дисоциират в катиони и аниони) в разтвор. Когато дадено вещество или съединение се дисоциира, то се дисоциира в положително зареден йон (катион) и отрицателно зареден йон (анион). Това са компонентите, които ще бъдат уравновесени в края на нетното йонно уравнение.
- Твърди вещества, течности, газове, молекулни съединения, йонни съединения с ниска разтворимост, многоатомни йони и слаби киселини няма да се дисоциират.
- Йонните съединения имат висока разтворимост (използвайте таблицата за разтворимост) и силните киселини ще йонизират 100% (HCl(дд), HBr(дд), Здравей(дд), H2ТАКА4(дд), HCIO4(дд)и HNO3(дд)).
- Забележете, въпреки че полиатомните йони вече не се отделят, ако те са съставна част на това съединение, те се отделят от съединението.
Изчислете заряда на всеки йон, отделен от съединението. Не забравяйте, че металите ще образуват положителни йони, а неметалите - отрицателни. Използвайте периодичната таблица, за да определите заряда на даден елемент. Трябва също така да балансирате заряда на всеки йон в съединението.
- В този пример NiCl2 дисоциирани в Ni и Cl, докато CrCl3 разделен на Cr и Cl.
- Ni има заряд 2+, защото Cl има заряд отрицателен, но има 2 атома. Следователно трябва да балансираме 2-те отрицателни йони Cl. Cr има заряд 3+, така че трябва да балансираме 3-те отрицателни Cl йони.
- Не забравяйте, че многоатомните йони имат специфичен заряд.
Запишете пълното йонно уравнение. Всичко, което дисоциира или йонизира (силни киселини) се разделя на два отделни йона. Състоянието на веществото остава (дд), но се уверете, че уравнението остава балансирано.
- Твърдите вещества, течностите, газовете, слабите киселини и йонните съединения с ниска разтворимост не променят състоянието си или се разделят на йони. Ние ги пазим непокътнати.
- Молекулните вещества ще се разпръснат в разтвор, така че състоянието им се променя на (дд). Три изключения не са да стане (дд) е: СН4(к), ° С3З.8(к)и C8З.18(л).
- Продължавайки с горния пример, пълното йонно уравнение изглежда така: 2Cr(r) + 3Ni(дд) + 6Cl(дд) -> 2Cr(дд) + 6Cl(дд) + 3Ni(r). Когато Cl не е в съединение, той не е биполярен, така че умножаваме коефициента по броя на атомите в съединението, за да получим 6 Cl йона от двете страни на уравнението.
Премахнете равновесните йони, като премахнете същите йони от всяка страна на уравнението. Можете да отмените само ако те са абсолютно еднакви от двете страни (заряд, атомен номер и т.н.). Напишете уравнението без разрушимите вещества.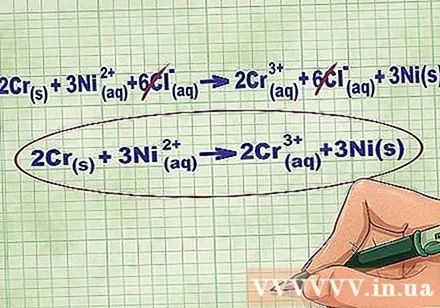
- След попълването на примера имаме 6 отменяеми Cl равновесни йона от всяка страна. Нетното йонно уравнение е 2Cr(r) + 3Ni(дд) -> 2Cr(дд) + 3Ni(r).
- Ако сте правилни, тогава общият заряд от страната на реагента трябва да бъде равен на общия заряд от страната на продукта в уравнението на нетните йони.
Съвети
- Запишете състоянията на всички вещества в уравнението, ако не и вие ще губят точки.